水素 を 失う 酸化
七輪 火 の 消し方酸化・還元の定義〜水素・酸素・電子の3パターン〜 | 化学の . よって、「水素H原子を失う=電子e ー を失う=酸化される」と考えることができる。 【高校化学の計算ドリル】大好評発売中! 高校化学・化学基礎の計算問題が苦手な人に向けた計算ドリルを発売しました。. なぜ水素hを失う=「酸化」で水素hを得る=「還元」なの . 水素が出入りすると電子が出入りするから. 酸化還元の定義は「 電子e-を失う=酸化、電子e-を得る=還元 」となっています。. この定義を基準に考えていきましょう。. ある原子が水素を得ると、電気陰性度の小さいHから他の原子に電子が移動し . 酸化と還元 - 酸素、水素、そして電子のやり取り | 図解で . 物質が水素を失う反応を酸化、水素と化合する反応を還元といいます。 硫化水素(H 2 S)と酸素(O 2 )の反応では、硫黄は酸化され、酸素は還元されます。. 水素原子を失うのがなぜ酸化なのですか?水素イオンは+がつい . 水素を失うと、水素以外の原子の酸化数は増えますので、酸化されたことになります。 例 メタン CH4……Cの酸化数-4、Hの酸化数+1 分解されると C と 2H2 になり、両方とも単体なので酸化数は0 炭素の酸化数はメタンの-4から単体の0になるので、酸化数が増えており、「水素を失って酸化された」となります。 >水素イオンは+がついてるから >失ったら酸化数が減って還元 これは水素自身のことをいっています。 水素原子は酸化数が+1から0に減るので、ここでは還元されていることになります。 酸化還元反応では必ず酸化と還元が同時に起こっており、この例では炭素が酸化され、水素が還元されています。 「水素を失うのは酸化」というのは、水素以外のところを見ていっているわけです。 NEW!. 【化学基礎】酸化と還元の定義をわかりやすく徹底解説!電子 . スイカ の よう な 小さな 実
車 鍵 の マーク今回は 酸化と還元の定義について、電子・酸素・水素の3パターンを原理を含めて徹底解説 していきたいと思います。 ぜひ最後までご覧ください。 ☆ 酸化と還元の定義(酸素) ☆ 酸化と還元の定義(電子) ☆ 電子に着目した定義の原理. ☆ 酸化と還元の定義(水素) ☆ まとめ. 舞 茸 離乳食 いつから
水 蓮 の 花びら☆ 酸化と還元の定義(酸素) 酸化と還元について、まずは 酸素に着目した定義 をご紹介します。 ただし、注意をしてほしいことが1つあり、 酸素に着目した定義をメインで使うのは、中学まで です。 高校から使う酸化と還元の定義は「電子」に着目 したものだと考えてください。 酸素に着目した定義において、 酸化 とは、 酸素と化合すること. 還元 とは、 酸素を失うこと. イク 時 は 震え ながら 無言 で 辻本 りょう
亜 脱臼 と は 肩をいいます。. 化学基礎 酸化・還元とは 酸化と還元の定義 - マナペディア. 水素を用いた定義では、 水素を失う反応を酸化 、 水素を得る反応を還元 と定義付けられています。 電子による定義. 最後に電子による定義です。 銅を酸化させて酸化銅 (Ⅱ)にした反応をみてみましょう。 Cu+O2→2CuO. 電子のレベルで考えると、 Cuは酸化されてCu2+となりO2-とくっついてCuOになった と考えることができます。 つまり. Cu→Cu2++2e- ※ (eは電子を表す) という反応をしていると捉えることができるのです。 このことから、 電子を失う反応を酸化 、 電子を得る反応を還元 と定義することができます。 総括. 以上のような酸化と還元の反応はまとめて 酸化還元反応 と呼ばれています。 ・ 化学基礎 酸化還元反応の問題~イオン反応式と化学反応式の作り方~. 酸化・還元とは?定義と意味をわかりやすく解説:還元した . 水素 が 酸化したんです! 水が酸化したわけじゃないよ。 水は関係ない! しつこいけど、水素が酸化しました。 下図は硫黄が酸化する様子。 ついでにいうと、金属も、食べ物も、私たちでさえも酸化してしまう。 金属がむき出しになった家は酸化してボロ屋になるし、食べ物も酸化するとくさっちゃう。 学生のとき、私はこう考えました。 「酸化はぶっちゃけ悪い反応である」と。 還元する. あなたの前に腐ったバナナがあります。 酸化しちゃってもう食べられません。 あなたは R という物質を注入して、腐ったバナナから酸素を奪いました。 すると、あら、もとのきれいなバナナに戻りました。 腐ったバナナ → きれいなバナナ + 酸素. 式で書くとこんな感じ。 Y → X + 酸素. 2つの酸化のメカニズム『水素を失う変化』とは?. 実は水素が失われることも酸化です! 今回は、水素を失うメカニズムについてご紹介します。 まずはじめに. 水素とは. 「水」の「素」と書くように酸素と結びつくことで水になる元素です。 元素記号は「H」. 元素周期表の最初に登場することでもよく知られていますね。 地球上では単体では存在するのが難しい物質です。 なぜなら軽すぎて宇宙に拡散してしまうからです。 宇宙空間では90%を占め、最も多く漂っています。 水素<水<地球<人類. 私たち人間も、水素がなければ誕生していないと思うと. 奇跡的なことですね。 そして水素は水以外にも色々な物質に結びついています。 オイルの中にも存在する. 多くのオイルには二重結合(=)があります。 これは他の物質と結びつきやすく、別の物質に変化しやすい. といえます。. 【高校化学基礎】「酸化・還元と水素」 | 映像授業のTry IT . 水素を失う変化を、 「酸化」 といいます。 水素を受け取る変化を、 「還元」 といいます。 このように、酸化・還元は水素から定義することも出来るのです。. 【高校化学】#02酸化と還元とは → High Chemi 【テスト対策】. 酸化 :反応して水素を失うこと. 還元 :反応して水素を受け取ること. つまり、酸素と逆ですね。 他にも酸素と水素は逆の関係になることが多いので、意識しておくと便利です。 さて先程の式ですが、水素に注目して. よって、H 2 Sが 酸化 されて、I 2 が 還元 されていました。 じゃぁ、次はどうでしょうか? Zn + H 2 SO 4 → ZnSO 4 + H 2. じゃぁ、これは? 2KI + Br 2 → 2KBr + I 2. そう、 酸素と水素だけでは全てを考えることができません 。 では、どうすればよいでしょうか? 酸化数から酸化還元を見分ける. 
二 等辺 三角形 底辺 の 長 さ酸化と還元の定義 | ねこでもわかる化学. 酸化:水素原子を得ること. 還元:水素原子を失うこと. 電子に注目した場合. 2Mg + O2 → 2MgO. 上記の化学反応式では、MgはOを受け取って酸化されいるので、還元反応はOに起こっていると考えられる。 つまりOは還元されている。 MgOはイオン結合による物質であるので、 Mg2+ と O2- で構成されている。 この電子の変化に注目すると、Mgは電子を失っているので酸化されたと言え、Oは電子を得たので還元されたと言える。 酸化:電子を失うこと. 還元:電子を得ること. 左酸化、右還元 ww.suggestkeyword.com/. 酸化・還元の定義 - 酸化還元 - Chemist Eyes. 化合物中の水素原子の酸化数は通常 であるが,ヒドリド として金属元素の原子と結合する場合は とする。 化合物中の酸素原子の酸化数は通常 であるが,フッ素と結合している場合は ,過酸化物 の場合は ,超酸化物 の場合は ,オゾニド の場合は とする。 イオン結合の化合物はシンプルで,例えば塩化カルシウム であればカルシウムイオンの酸化数が ,塩化物イオンの酸化数が となります。 硫酸イオン は総電荷が なので,硫黄原子の酸化数は です。 過酸化水素 では,水素の酸化数は で原則通り,酸素は過酸化物なので例外規定により,酸化数が となります。 共有結合の化合物では電気陰性度の大小で電子の帰属が決まります。. 第35章 酸化と還元 - Osaka Kyoiku. (1) 酸素の授受と酸化還元 物質が酸素と化合して酸化物になる反応→ 酸化 2Cu + O 2 → 2CuO 酸化物が酸素を失う反応→ 還元 CuO + H 2 → Cu + H 2 O. 医療 用 帽子 どこで 売っ てる
天理教 の 有名人(2) 水素の授受と酸化還元 水素を失う反応→酸化 水素と結びつく反応→還元 2H 2 S + O 2 → 2S + 2H 2 O H 2 S + I 2 → S + 2HI. (3) 電子の授受と酸化還元 物質が電子を失う変化→酸化 物質が電子を得る変化→還元 酸化と還元は必ず同時に起こる→ 酸化還元反応. 授受. O. H. e -. 酸化. Oと結びつく. 化合物がHを失う. e - を失う. 還元. 酸化物がOを失う. Hと結びつく. e - を受け取る. 【高校化学基礎】「酸化・還元」(練習編) | 映像授業のTry IT . 水素を失う「酸化」、水素を受け取る「還元」 (1)です。 この問題では、ある物質からもう片方へと 水素が移動 していますね。 水素 に注目して考えてみましょう。 メタンCH 4 は、 水素を失っています. それに対して、酸素O 2 は、 水素を受け取っています 。 よって、酸化された原子は C で、還元された原子は O です。 酸素を受け取る「酸化」、酸素を失う「還元」 (2)です。 この問題では、ある物質からもう片方へと 酸素が移動 していますね。 酸素 に注目して考えてみましょう。 酸化鉄Fe 2 O 3 は、 酸素を失っています。 一方、アルミニウムAlは 、酸素を受け取っている ことがわかります。 よって、酸化された原子は Al 、還元された原子は Fe です。 酸化・還元. 【化学】酸化還元反応とは? | ねこでもわかる生物学. 酸化の定義Ⅱ:水素を失う. 次の反応では、硫化水素は水素原子を失っています。 一方、O2は水素を得ています。 2H 2 S + O 2 → 2S + 2H 2 O. この場合、ある物質が水素を失う変化を酸化、水素を得る変化を還元と呼びます。 酸化の定義Ⅲ:電子を得る. 次の反応では、マグネシウムと酸素が結合します。 その際には電子の授受がなされます。 2Mg + O 2 → 2MgO. 金属元素と非金属元素の結合ですから、 イオン結合 を形成します。 2Mg → 2Mg 2+ + 4e -. O 2 + 4e - → 2O 2- Mgは電子を失い、Oは電子を得ます。 このように物質が電子を失うと酸化された、電子を得ると還元されたと言います。. 3分で簡単酸化還元反応!化学反応式をまじえて見分け方や . 酸素ではなく、水素のやりとりによって酸化反応および還元反応を定義することもできます。 結論を先に述べると、 水素を失う反応を酸化反応、水素を得る反応を還元反応 とする方法です。 なぜ酸化還元反応に水素が関係してくるのか、メタンと酸素が結びつく反応、つまりメタンガスの燃焼を例に考えてみましょう。 image by Study-Z編集部. 炭素原子に注目すると、反応前後で酸素と化合して二酸化炭素となるので、炭素原子は酸化したと言えます。 ここで重要なポイントとなるのは、 炭素原子は酸化するときに、酸素と結合すると同時に水素原子を失っている ことです。 反応によっては酸化の際に元の原子が水素を失うことがあるため、 水素を失う反応も酸化反応と定義 したんですね。. 7-1. 酸化と還元|おのれー - note(ノート). 要は、酸化するために、水素原子を失うこともあるわけです。 このように、物質が酸素と反応するときには、酸素と結びつく代わりに水素を失うことがあります。 そこで、 水素を失う反応も酸化 といい、逆に 水素と結びつく反応も還元 と定義することもできます。 では、酸素原子が出てこない反応についても、この定義をあてはめて、酸化されているか、還元されているのかを考えてみましょう。 このように考えれば、酸素原子が関わらない反応でも、酸化されたり、還元されたりということがあるのだということが分かるかと思います。 ここでまた、問題を解いてみましょう。 なぜ、酸素原子が関係しなくても酸化還元反応と言えるのか?. 酸化還元. もし水素 H 2 が酸化されたというのなら、水素 H 2 は水素イオン H + となって、電子 e-を酸素 O 2 に受け渡し、酸素 O 2 は水素 H 2 から電子 e-を受け取って、酸化物イオン O 2-になるはずです。. 【高校化学基礎】「酸化・還元と電子」 | 映像授業のTry IT . 酸化・還元を見極めるには、酸素や水素の他に、 電子 に注目する方法があります。 その方法について、詳しく学習していきましょう。 電子を失う「酸化」、電子を受け取る「還元」 先ほどの銅と酸化銅の反応をもとに、どのように電子が動いているのか見てみましょう。 2つある銅の原子から、それぞれ2e - の 電子 が出ていますね。 その電子が酸素に移動すると、銅と酸素はそれぞれイオンになって、酸化銅が発生するのです。 電子を失っている銅は、酸化された物質でした。 一方、電子を受け取っている酸素は、還元された物質でしたね。 このことから、次の内容がわかります。 「酸化」 とは、「原子またはその原子を含む物質が 電子を失う 変化」です。. 酸化と還元|酸化数から酸化還元反応を考えよう|ふかラボ. 酸化 :物質が酸素と結合すること、水素を失うこと、電子を放出すること. 還元 :物質が酸素を失うこと、水素と結合すること、電子を受け取ること. クリックできる目次. 酸化と還元. 酸素のやり取り. 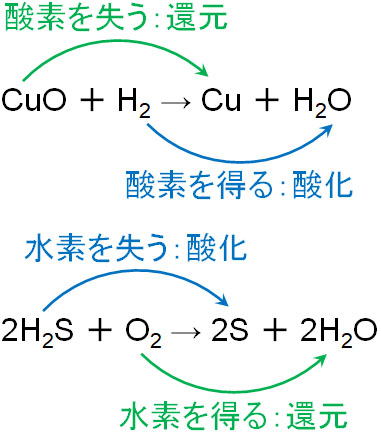
中庭 の ある 平屋 間取り 図1.1 電子の受け渡しが酸化還元反応で重要. 1.2 それぞれの原子の酸化数を数える. 1.3 酸化還元反応により、酸化数が増減する. 2 酸化還元反応と中和反応の違い. 3 酸化数を数え、酸化と還元の区別を行う. 酸化還元反応を酸素と水素で理解する. 私たちの身の回りで発生しているさまざまな現象を化学で学びます。 その一つが酸化還元反応です。 例えば、以下のような金属のサビを私たちは何度も見ていると思います。 金属が酸化すると、金属は光沢を失ってボロボロの状態となります。 また、洗濯や殺菌をするときに漂白剤を利用することがあります。 漂白剤には次亜塩素酸(HClO)が入っており、これは強力な酸化剤です。. 酸化還元反応 定義と電子の授受 - 効率学習研究会. 物質の変化. Tweet. 酸化と還元の反応は酸素と水素の受け渡しで定義できます。 しかしそれだけでは説明できない酸化還元反応もあります。 定義の範囲を広げて電子の授受、つまりは電子の受け渡しで酸化還元反応が定義できるようになりますので確認しておきましょう。 酸化・還元の定義. 酸化とは. 狭い意味では、 物質が 酸素を受け取る (結合する)こと、 または化合物から 水素がとれる (化合物が水素を渡す)ことを 酸化 といいます。 CuO + H2 → Cu + H2O. この反応では、 水素は酸素と結合しているので酸化されています。 「酸化」と単純に使う場合は「酸化される」ことを言いますので覚えておきましょう。. 米政府、Co2を出さない「クリーン水素」に1100億円の助成金を . バイデン政権は3月13日、総額7億5000万ドル(約1100億円)の助成金を、二酸化炭素(CO2)を発生させないクリーン水素テクノロジーを開発する企業 . 火力の水素・アンモニア代替、世界発電量の1%だけ 2050年試算. 火力発電所で天然ガスや石炭の代わりに、燃焼時に二酸化炭素(CO2)を出さない水素やアンモニアを使う対策が検討されているが、京都大の研究 . トラック"改造" 水素エンジンに - Nhkオンライン. ディーゼルトラックのエンジンを改造して「水素エンジン」にする技術に注目。EV=電気自動車や、水素で電気をつくるFCV=燃料電池車は . 水素・二酸化炭素・バイオマス由来原料を使う燃料が未来を . 水素と一酸化炭素を合成させると、グリーンLPガスができる。一酸化炭素、水素の原料として、CO 2 やバイオマス由来の発酵メタンガス等が使われる。 ・課題 合成の効率を高めるための技術開発や触媒等の開発が求められる。. アイシンが産業用sofc実用化へ…水素環流で高効率発電 . アイシンは家庭用燃料電池「エネファーム」で培った技術を生かし、高効率な産業用純水素固体酸化物形燃料電池(SOFC)や固体酸化物形電解セル . 燃料電池はバイオ燃料を用いた固体酸化物型、日産の選択 . 「バイオエタノールを用いた固体酸化物型燃料電池(SOFC)による定置型発電システムは、当社がカーボンニュートラル(温暖化ガス排出量実質ゼロ、CN)を達成するための大きな柱の1つになる。時間はかかるが、先を見据えてしっかりと取り組みたい」──。日産自動車常務執行役員の村田 . ニッケル酸化物超伝導体が高温で超伝導になる理由を理論的に . 高温超伝導の歴史は銅酸化物に始まり、鉄系超伝導、超高圧下における水素化物(典型的に200万気圧の圧力下でT c >200 K)と続いてきました。水素化物と、銅酸化物や鉄系超伝導との大きな違いは、超伝導の発現機構にあります。前者. 酸化還元反応とは?反応式の書き方・コツをわかりやすく解説|高校生向け受験応援メディア「受験のミカタ」. 酸化とは、ある物質が酸素と化合物して、水素を奪われること、または、電子を失うこと 。 そして、 還元とは、ある物質が酸素を奪われて水素と化合すること、または、電子を受け取ることです 。 酸化と還元の概念には2つの考え方があります。. 物質から水素を失うと!なぜ酸化となるのですか? -乙種4類危険物です- 警察官・消防士 | 教えて!goo. 乙種4類危険物です。「物質から水素を失うと!なぜ酸化となるのですか?」 そもそも水素を持っていない物質は酸化はどうなるのでしょうか? 馬鹿覚えはでは、すぐに忘れてしまいます。 化学的な理由の ご教授をよろしくお願いいたし. はじめに - 酸化還元 - Chemist Eyes. 中学校では酸化とは「物質が酸素と化合して酸化物になること」,還元とは「酸化物が酸素を失うこと」と教わります。. 例えば,銅 を空気中で強熱する実験では が酸化されて酸化銅 になり,そして加熱した を水素と反応させると, が還元されて単体の銅 . 酸化還元反応 - Wikipedia. 酸化還元反応の例。水素は酸化され、フッ素は還元されている。 酸化還元反応(さんかかんげんはんのう)とは化学反応のうち、反応物から生成物が生ずる過程において、原子やイオンあるいは化合物間で電子の授受がある反応のことである。. 酸化還元反応:物理学解体新書. またこの酸化還元反応を通して、水素と酸素が逆の働きを持っていることも分かる。 水素による還元反応は非常に種類が多い。 そこで酸化還元を、「物質が水素と化合する反応を還元反応、物質が水素を失う反応を酸化反応」と拡張して解釈することも . 酸化(さんか)とは? 意味や使い方 - コトバンク. 酸化さんかoxidation. 物質が酸素と反応して酸化物となること。. さらに広い意味から無機水素化物,有機化合物から水素の除去される脱水素反応も酸化として定義される。. また電子の移動に基づく定義として,反応にあずかる元素が正の 酸化数 を増すか . 酸化還元反応とは? 酸化・還元・酸・アルカリ・塩基・ベース: スタディヘルプ. 水素原子=「H」=活性水素 。プロトン(陽子)1個、電子1個の組み合わせ。 A. 酸化とは:3つの定義あり1.電子を失うこと自分の電子e−を奪われる = 自分は酸化される(相手を還元する)。相手の電子e−を奪う = 相手を酸化する(自. 酸化は水素を奪われる? -酸化は、電子を奪われることであり、水素を奪- 化学 | 教えて!goo. 酸化は、電子を奪われることであり、水素を奪われることという意味が分かりません。電子はマイナス、水素はH+なのに。教えてください。確かにNo.1の方のいうとおり、それが定義です。化学の世界でいう"酸化"は、次の3つすべてを指します. 【中学理科】酸化銅の還元を実験動画も使って解説. 酸化銅は、炭素の代わりに水素を使っても還元ができる んだ。 その場合の化学反応式も解説して終わりにするよ! 水素を使った酸化銅の還元の化学反応式 は下のとおりだよ! CuO + H 2 → Cu + H 2 O. だよ! 水素を使うと、還元後に水ができると覚えておこう。. 【高校化学】表で覚える酸化と還元の定義 | 定額個別指導塾の櫻学舎|仙台五橋|家での勉強が1時間未満の子の為の学習塾. ウサギ の 入れ墨 意味
フットサル ボール 外 で 使うつまり、水素は酸素と逆の反応を示すのです。 改めて書き直すと「酸化」は水素を「失う」反応で、「還元」は水素を「得る」反応です。 3 電子の移動. 次に電子の移動ですが、主に電気分解の時にこの定義を用います。. 酸化数の8つの原則と2つの例外|酸化・還元の程度の求め方. 酸化数の定義. 酸化数 とは「各元素がどれくらい酸化しているかの指標」を表すもので,次の8つの原則と2つの例外により定められます.. もう少し詳しく言えば「物質に含まれる各元素の周囲の電子が,単体の時と比べてどれくらい増減しているか」を表し . ⑦酸化と還元(問題)|過去問研究所@乙4危険物取扱者. ⑦酸化と還元 ⑥物質の成り立ち 問1 酸化、還元について次のうち誤っているものはどれか。 ①物質が酸素と化合する反応を酸化といい、酸素物から酸素を奪う反応を還元という。 ②水素を失う反応を酸化といい、水素が結びつく反応を還元という。 ③酸化とは物質が電子を受け. なぜ水素化ナトリウムNaHの水素Hの酸化数は-1なの? | ねこでもわかる化学. Naの方が電気陰性度(電子を引き寄せる力)が小さいから. 殆どの化合物ではHの酸化数は+1ですが、水素化ナトリウムNaHではHの酸化数は-1となります。. 水素化ナトリウムNaHは Na+とH-によるイオン結合性の物質 です。. つまり、Hは電子を1つ余計に得ているの . 水素添加と還元反応の違いとは?分かりやすく解説! | トーマスイッチ. 結論. 水素添加は還元反応の一種である。. 不飽和化合物を飽和化合物に変換するのに使われる。. 還元とは、化学種の酸化数を減少させることである。. 酸化反応と並行して必ず起こる。. 水素添加と還元の大きな違いは、水素添加は基本的に触媒を必要と . PDF 第3章 酸化還元反応 1 酸化と還元 ≪「酸化さ . - Bekkoame. 1「酸化される」とは・・・酸素と化合すること。水素を失うこと。電子を失うこと。 2 還元される とは・・・酸素を失うこと 水素と化合すること 電子をもらうこと「」 。 。 。 3(相手がいなければ電子は移動できない。酸化と還元は常に同時に起こる。. 電子伝達系とはなに?図を多用してわかりやすく解説してみた. 内膜を流れるe - (電子) によって引き起こされた酸化還元反応のエネルギーを利用して、H + (水素イオン) が膜間腔に移動します。 一部のH + (水素イオン) は、ミトコンドリアの内膜を流れる電子と反応し水素 (H 2 ) となり、さらに酸素 (O) と . 酸化数(求め方・ルール・例外・例題・一覧・演習問題) | 化学のグルメ. はじめに 【プロ講師解説】このページでは『酸化数(求め方・ルール・例外・例題・一覧・演習問題)』について解説しています。 酸化数とは 物質のもつ電子が基準よりも多いか少ないかを表した値を酸化数という。 酸化された物質は、マイナスの電荷をもつ. 危険物乙4「酸・塩基、酸化と還元、酸化剤・還元剤」の勉強方法. 物質が酸素と化合すること(または、水素を失うこと)を 酸化 といいます。 物質が酸素を失うこと(または、水素と化合すること)を 還元 といいます。 酸化と還元は 同時 に起こります。 最近の出題傾向 酸の性質:青色リトマス紙を赤変させる。. 酸化(さんか)とは? 意味・読み方・使い方をわかりやすく解説 - goo国語辞書. 酸化(さんか)とは。意味や使い方、類語をわかりやすく解説。[名](スル)物質が酸素と化合すること、または水素を失うこと。一般には原子または原子団から電子を取り去ること。→還元 - goo国語辞書は30万9千件語以上を収録。政治・経済・医学・ITなど、最新用語の追加も定期的に行ってい . 第三部:化学反応 酸化・還元反応 - Sekigin. 酸化( oxidation ) 対象とする物質(原子)が電子を失うことである。 酸化反応には,酸素と化合する反応が多いため,一般的には,物質が酸素と化合して酸化物になる反応のみを酸化と誤解しているケースが少なくない。 実際には,物質から水素が奪われる反応,酸素や水素の関わらない反応 . 第70章 アルデヒド - Osaka Kyoiku. 第70章 アルデヒド. 08ko-070. ヤシ の 木 枯れ た
痰 に 血 が 混じる 子供1.. 酸化とはどのような反応ですか?. 物質が酸素と化合して酸化物になる反応 物質が水素を失う反応 物質が電子を失う変化 2.還元とはどのような反応ですか?. 酸化物が酸素を失う反応 物質が水素と結びつく反応 物質が電子を . 酸化|株式会社ケミコート. 酸化(さんか、英:oxidation)とは、対象とする物質が電子を失う化学反応のことです。. 具体的には、物質に酸素が化合する反応、あるいは、物質が水素を奪われる反応等のことです。. 酸化は還元の逆です。. 鉄がさびて酸化鉄になる場合、鉄の電子は酸素 . ⑥酸化還元反応:電子のやり取り - 未来ecoシェアリング. ・水素と化合していた炭素は、水素を失い、酸素と化合している. ⇒酸化:物質が酸素を得る、又は水素を失う反応. 次に、この反応の前と後で『酸素原子o』に注目する。 反応前:o₂. 反応後:h₂o ・酸素は水素を得ている. ⇒還元:物資が酸素を失う又は . 【高校化学基礎】「物質の変化(テスト8、第1問)」(問題編1) | 映像授業のTry IT (トライイット). イ 水素を失った物質は還元されたと言える。 水素と酸化・還元の関係を思い出しましょう。 酸化は、 水素を失う 変化でした。 還元は、 水素を受け取る 変化でしたよね。 よって、イは、 誤った内容 です。. 万病に効く?水素は酸化還元で病を治す | 「健康365」公式Webメディア 365カレッジ. ②物質が水素を失う反応=酸化、水素と結びつく反応=還元 ③物質が電子を失う反応=酸化、電子を受け取る反応=還元 酸化還元反応はもともと酸素に着目して説明されていましたが、その後、酸素、続いて水素が関与せずに電子の受け渡しを伴う反応が . 酸化還元電位 | 一般社団法人国際水素規格協会. 逆に、「還元する」とは、酸素を失うこと、水素を受け取ること、電子を受け取ることなどと定義されます。 この酸化還元電位は、液体に含まれる水素量を測定するのに優れていると考えられていますが、水素以外の還元物質に反応して数値化されることが . 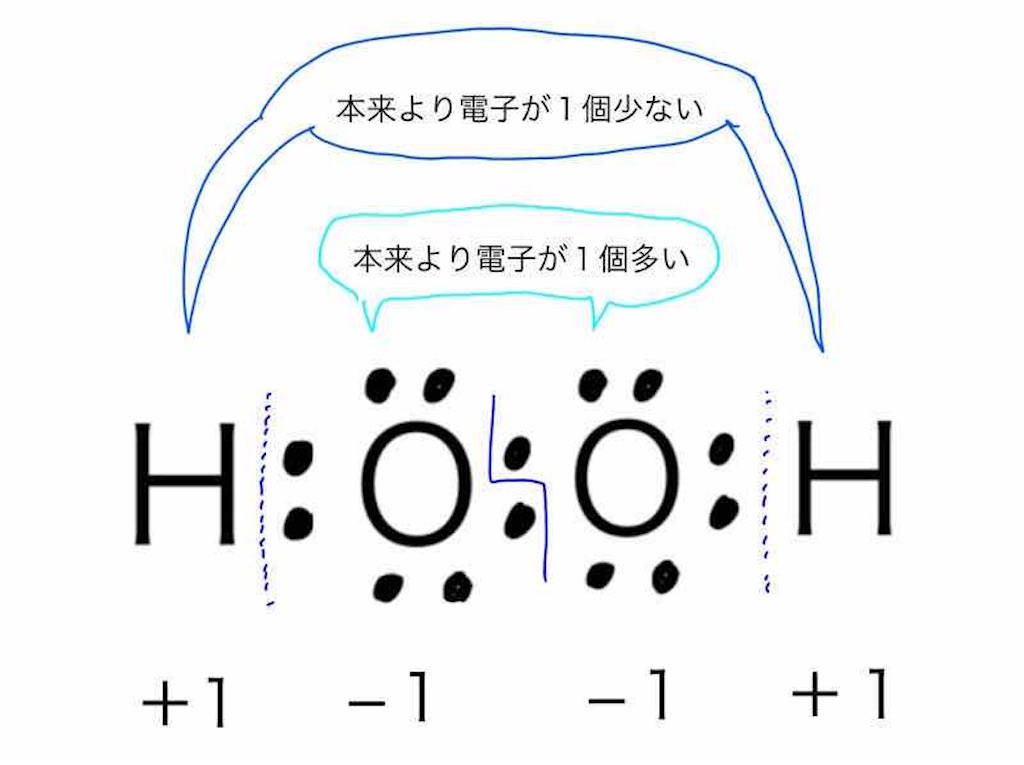

中野 家 の 家紋酸化と還元が同時に関与する反応.ある物質に酸素を与えるか水素を奪うか,または 元素 あるいは イオン から電子を奪って酸化数を増加させる 現象 を酸化という.逆に,ある物質から酸素を奪うか水素を与えるか,または元素あるいはイオンに電子を . なぜ原子が電子を失うことを「酸化」と呼ぶのですか。常識で考えて原. - Yahoo!知恵袋. なぜ酸化は電子を失うことを言うのですか? 例えば水はh2oでo2-とh+で、この場合だと水素が酸化されたとなるはずですが どう考えても水素は陽イオンで酸素が陰イオンだから電子を失ってるのは マイナスの電荷を帯びている酸素ではないんでしょうか そうなると酸素が電子を失っているので . 酸化は「サビつかせる」、還元は「サビをとる」 | 水素ラボ 水素で健康をデザインする | 日本水素推進機構. 対象とする物質が電子を失う化学反応のこと。具体的には、物質に酸素が化合する反応、あるいは、物質が水素を奪われる反応などである。例えば、鉄がさびて酸化鉄になる場合、鉄の電子は酸素(o2)に移動しており、鉄は酸化されていることが分かる。. 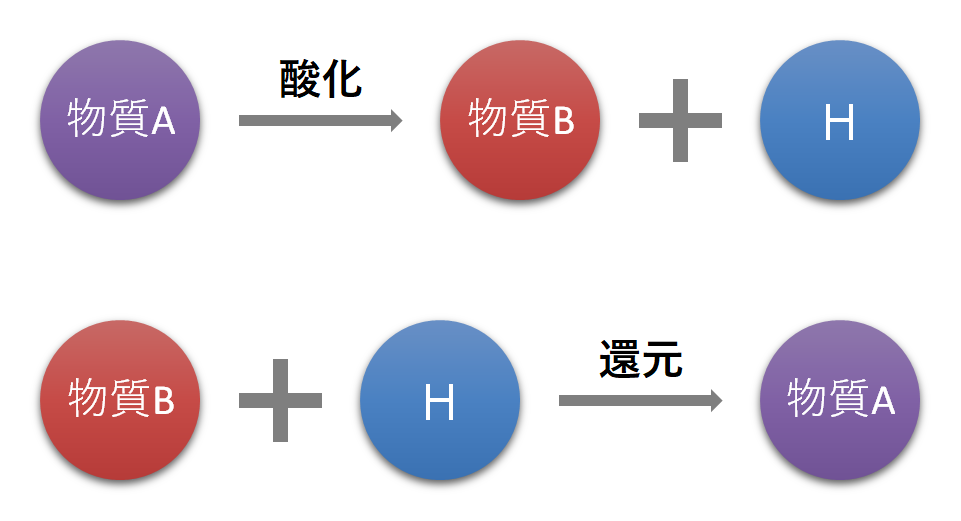
PDF 物理化学i-第12回(12). 酸化:電子を失う過程 (狭くは酸素原子と結合する過程,水素原子を失う) 還元:電子を獲得する過程 (水素原子と結合する過程,酸素原子を失う) ・酸化剤と還元剤 酸化剤:反応において,電子を相手から奪う物質(自身は還元されやすい). PDF 物理化学I-第12回(13) - Doshisha. 酸化:電子を失う過程 (狭くは酸素原子と結合する過程,水素原子を失う) 還元:電子を獲得する過程 (水素原子と結合する過程,酸素原子を失う) ・酸化剤と還元剤 酸化剤:反応において,電子を相手から奪う物質(自身は還元されやすい).